武漢肺炎新冠病毒“特效藥”瑞德西韋,浙大教授:别随便用
美國首例“新冠”患者使用瑞德西韋治療後大幅好轉,中國火速受理臨床試驗申請
美國第一例新型冠狀病毒(2019-nCoV)的肺炎患者經過一種尚處于臨床試驗階段的新藥治療後,病情迅速出現了好轉。
圖片來源 / 圖蟲創意
美國首例“新冠”患者治療後大幅好轉
1月31日,頂尖醫學期刊《新英格蘭醫學雜志》(NEJM)在線發表了一篇關于美國首例新型冠狀病毒(2019-nCoV)确診病例的論文,詳細介紹了該患者就醫、治療以及臨床表現。
其中最引人注意的是,這名患者在接受了一種叫做remdesivir的抗病毒藥物治療後,出現了大幅改善,“截至1月30日,患者仍在住院,但除了咳嗽,其他症狀都好了,而且咳嗽的嚴重程度在減輕。”
該論文作者包括流行病情報局(MLH),國家免疫與呼吸疾病中心(AC,LF,AP)病毒疾病司,亞特蘭大疾病控制與預防中心的流感處(TMU)和準備和新發感染處(SKP);華盛頓州衛生部等。
以下爲論文的一些關鍵内容:
我們報告了在美國确認的首例2019-nCoV感染病例,并描述了該病例的鑒定、診斷、臨床過程和管理,包括患者在病情第9天出現肺炎時的最初輕度症狀。該案例強調了臨床醫生與地方、州和聯邦各級公共衛生當局之間密切協作的重要性,以及需要迅速傳播與這種新發感染患者的護理有關的臨床信息的需求。
2019年12月31日,中國報告了與湖北省武漢市華南海鮮批發市場有關的人群中的肺炎病例。2020年1月7日,中國衛生當局确認與新型冠狀病毒2019-nCoV有關。盡管最初報道的病例與武漢市海鮮市場的暴露有關,但當前的流行病學數據表明,正在發生人際傳播。截至2020年1月30日,在至少21個國家/地區報告了9976例病例,包括2020年1月20日報道的美國首例确診的2019-nCoV感染病例。
案例報告:
2020年1月19日,一名35歲的男子出現在華盛頓州斯諾霍米什縣的一家急診診所,有4天的咳嗽和主觀發燒史。病人到診所檢查時,在候診室戴上口罩。等待大約20分鍾後,他被帶到檢查室接受了檢測。他透露,他在中國武漢探望家人後于1月15日返回華盛頓州。該患者表示,他已經從美國疾病控制與預防中心(CDC)收到有關中國新型冠狀病毒暴發的健康警報,由于他的症狀和最近的旅行,他決定去看醫生。
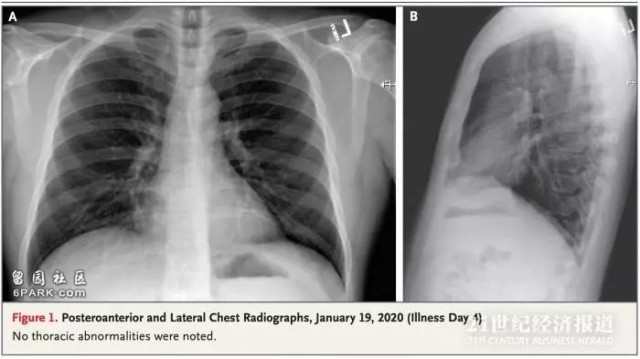
2020年1月19日(疾病第4天)的後前胸和外側胸片。
除了有高甘油三酸酯血症的病史外,該患者是不吸煙的健康人群。患者體溫爲37.2°C,血壓爲134/87 mm Hg,脈搏爲每分鍾110次,呼吸頻率爲每分鍾16次,氧飽和度爲96%。肺部聽診顯示有支氣管炎,并進行了胸片檢查,未顯示異常。
檢測獲得了鼻咽拭子标本,将其送去檢測病毒性呼吸道病原體。在48小時内對所有測試的病原體均呈陰性,包括甲型和乙型流感,副流感,呼吸道合胞病毒,鼻病毒,腺病毒和已知會導緻人類疾病的四種常見冠狀病毒株(HKU1,NL63、229E和OC43)。
患者說他沒有到過華南海鮮市場,但疾控中心認爲有必要對患者進行2019-nCoV測試。根據CDC指南收集了8個标本,包括血清、鼻咽和口咽拭子标本。标本采集後,患者被送往家庭隔離,并由當地衛生部門進行監測。
1月20日,美國疾病預防控制中心(CDC)證實,該患者的鼻咽和口咽拭子通過實時逆轉錄酶-聚合酶鏈反應(rRT-PCR)檢測爲2019-nCoV陽性。患者被送往醫療中心隔離病房進行臨床觀察。
入院時,患者持續咳嗽,并有2天的惡心和嘔吐史,沒有呼吸急促或胸痛。生命體征在正常範圍内。患者接受了支持治療,包括2升生理鹽水和恩丹西酮以緩解惡心。
在住院的第2至5天(患病的第6至9天),患者的生命體征基本保持穩定,除了出現間歇性發燒并伴有心動過速。咳嗽,并出現疲倦。在醫院第二天的下午,患者排便不暢,腹部不适。收集其糞便的樣品測試,以及其他呼吸道标本和血清。糞便和兩個呼吸道标本随後均通過rRT-PCR檢測爲2019-nCoV陽性,而血清仍爲陰性。
在此期間的治療在很大程度上是支持性的。爲了進行症狀處理,患者需要根據需要接受解熱療法,該療法包括每4小時650 mg對乙酰氨基酚和每6小時600 mg布洛芬。在住院的前六天,他還因持續咳嗽而服用了600毫克愈創甘油醚和約6升生理鹽水。
患者從在醫院第3天開始可以進行全血細胞計數和血清化學研究。有白細胞減少症,輕度血小闆減少症和肌酸激酶水平升高,肝功能指标也有所變化。
但是從入院第5天晚上(患病第9天)晚上進行的第二次胸部X光片檢查顯示,左肺下葉有肺炎。這些影像學發現與從醫院第5天晚上開始的呼吸狀态變化相吻合,當時患者在呼吸周圍空氣時通過脈搏血氧飽和度測定的血氧飽和度值降至90%。在第6天,患者開始吸氧,并使用萬古黴素和頭孢吡肟治療。
在醫院第6天(患病第10天),第四次胸部X射線照片顯示兩個肺中都有基底條狀混濁,患者持續發燒,多個部位持續陽性,嚴重肺炎。
于是,在入院的第7天,醫生開始使用了一種尚在研發階段的抗病毒藥物進行靜脈注射,未觀察到與輸注有關的不良事件。并停用萬古黴素和頭孢吡肟。
緊接着轉折來了,第8天,患者的臨床狀況得到改善。并停止吸氧,氧飽和度值提高到94%至96%。先前的雙側下葉羅音不再存在。他的食欲得到改善,除了間歇性幹咳和鼻涕外,沒有其他症狀。截至2020年1月30日,患者仍住院。他已經不再發熱,除咳嗽外,所有症狀均已緩解,咳嗽的程度正在減輕。
好消息!國家藥審中心火速受理“新冠”藥物remdesivir臨床試驗申請
新冠肺炎潛在有效藥瑞德西韋臨床試驗申請獲中國藥監部門受理
2月2日上午,國家藥監局藥品評審中心(CDE)網站顯示,新型冠狀病毒感染肺炎的潛在有效藥物瑞德西韋(remdesivir)臨床試驗申請已經獲受理。受理文件顯示,注冊企業爲吉利德科學與中國醫學科學院藥物研究所。
據澎湃新聞此前從該藥物的研發公司吉利德獲知的消息,瑞德西韋治療新型冠狀病毒(2019-nCoV)肺炎的臨床試驗,将于2月3日在中國啓動。
據悉,吉利德将配合中國的衛生部門開展一項随機、對照試驗,以确定使用Remdesivir治療2019-nCoV感染者是否安全和有效。
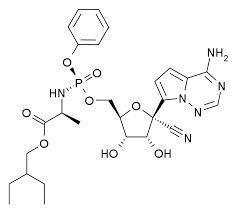
Remdesivir是一種核苷酸類似物前藥,能夠抑制依賴RNA的RNA合成酶(RdRp)。這款在研藥物原本是針對埃博拉病毒研發的,剛剛在美國的一起案例中被證明對新型冠狀病毒感染的肺炎有效。
國家藥審中心網站披露的工作流程顯示,一般藥物的臨床試驗申請審評時間爲60日,而瑞德西韋的注冊申請被火速受理也體現了我國新藥審評審批制度中特事特辦的原則。
北京時間2月1日,吉利德科學全球首席醫療官Merdad Parsey博士代表公司發布聲明,公司正與全球衛生機構密切合作,提供在研藥物瑞德西韋用于試驗性治療,以支持應對新型冠狀病毒(2019-nCoV)感染的爆發。
remdesivir(瑞德西韋)最初是爲抗擊埃博拉研發
浙大教授:新冠病毒“特效藥”瑞德西韋,别随便用
浙江大學教授王立銘在其微博發布了關于謹慎使用瑞德西韋的提醒長文。以下是其全文:
2020年2月1日,兩條看起來毫不相關的新聞突然刷爆了社交網絡。但挺巧合的是,兩條新聞都涉及到新冠病毒肺炎的可能新療法:
第一條來自《新英格蘭醫學雜志》。美國華盛頓州衛生局的一些科學家報道了他們如何治療美國本土第一例新冠病毒肺炎患者。他們提到一種名叫瑞德西韋(remdesivir)的藥物,在患者住院的第七天,醫生們爲他靜脈注射了瑞德西韋,轉天患者的情況就出現了好轉:血氧濃度上升、肺部啰音消失、食欲也有所恢複。截至1/30日患者仍然在住院接受治療,但是情況已經大大好轉。(Holshue ML et al NEJM 2020)
第二條來自中國科學院。中科院上海藥物所和武漢病毒所的科學家們聯合發現,中成藥雙黃連口服液可抑制新型冠狀病毒。根據報道,雙黃連口服液已在上海公共衛生臨床中心、華中科技大學附屬同濟醫院開展臨床研究。
雙黃連這裏壓住不表,我們就來說說瑞德西韋。這是個什麽藥?到底有沒有用?應該怎麽用?
這是個什麽藥?
在前面的科普文裏我講到了一個藥物研發應用的基本規律:在正式推廣應用之前,一定要經曆臨床前研究-人體臨床試驗這兩個根本無可替代的環節。
人體臨床試驗這個大家好理解,就是在大規模人群當中測試一種藥物的安全性和有效性。理論上說,經過嚴肅設計和執行的大規模随機對照臨床試驗具有最高級别的可信度。簡單來說就是招募合适的人,随機分成兩組,一組服藥,另一組使用安慰劑或标準治療,然後在一段時間後比較服藥組人群的疾病情況顯著好于安慰劑組,并且副作用可以接受,那麽我們就可以說這種藥物真的管用。當然在現實情況中,特别是在臨床需求特别急迫的時候(比如很多癌症晚期患者和傳染病爆發期),人體臨床試驗的要求可以适當的有所放寬,這種情況大家也容易理解。
而所謂臨床前研究,指的是在真正進入人體試驗之前,所有在實驗室裏完成的必須研究工作,包括找到和完善候選的藥物分子、在細胞和動物模型裏做各種安全性和有效性的測試等等環節。隻有在這個環節通過各種測試的藥物分子,才能進入下一步,在人體上進行測試。這裏頭的道理很簡單,咱們通俗點說,人命關天,咱們至少得大緻确保一個東西無毒無害還有用,才能給人用、特别是病人用把?
帶着這個基本的知識,我們再去看看瑞德西韋這種藥物。
這種藥物可不是爲新冠病毒肺炎專門開發的新藥——誰也做不到這麽快開發一款新藥。它是美國吉利德制藥公司(Gilead)針對埃博拉病毒開發的一款藥物。在臨床前研究中,這款藥物被發現能夠抑制埃博拉病毒一個名叫RdRP的蛋白質——這個蛋白質對于埃博拉病毒在人體細胞内的複制繁殖至關重要(Tchesnokov EP et al Viruses 2019),因此能夠起到很強的病毒抑制作用(McMullan LK et al Lancet 2019)。
但是,在2019年年底發表的一項大規模人體臨床試驗中,科學家們在剛果共和國的埃博拉疫情中測試了幾種可能的藥物,發現瑞德西韋的效果遠不如另外兩個單克隆抗體藥物(REGN-EB3和MAb114)(Mulangu S et al NEJM 2019)。盡管從嚴格意義上說瑞德西韋仍然是一種尚在研究過程中的藥物,但是它以埃博拉藥物的身份獲得上市批準已經是極其渺茫的一件事情。
但是這本身不意味着瑞德西韋的徹底死亡。
抗病毒藥物有一個很有趣的特點,它們大多是針對病毒生存周期中至關重要的一些蛋白開發出來的,比如我們剛剛提到的這個RdRP蛋白(我們前面文章提到的克立芝針對的是艾滋病毒的蛋白酶,HIV-1 protease)。但是很多病毒的類似重要蛋白其實是非常相似的——這個倒是也不難理解,病毒這類簡單生命能夠玩出的花樣其實很有限。
所以,一個針對病毒A設計出來的抗病毒藥物,往往也能對不少類似的病毒BCD有療效。比如我們提到過克立芝也許就能用來治療本次的新冠病毒肺炎,在這裏,瑞德西韋被用來治療新冠病毒肺炎患者,也是類似的思路。雖然本職工作(對抗埃博拉病毒)不太到位,但是萬一副業(對抗新冠病毒)能牆裏開花牆外香呢?
但是請注意,有這種“牆裏開花牆外香”的可能性,可不意味着我們就可以把瑞德西韋當成新冠病毒肺炎特效藥,不意味着我們就應該立刻把它拿來給所有病人們用了!
這道理也很簡單,雖然瑞德西韋已經完成了臨床前研究和人體臨床試驗,但是可都是以抗埃博拉病毒藥物的身份參與的。現在要把它用于一種全新的病毒和一種全新的疾病,就算此前的很多數據積累可以讓我們大大加快其推進速度,該有的步驟仍然是必不可少的。
我們退一步說,即便考慮到瑞德西韋在此前的人體臨床試驗中看起來安全性還不錯(Mulangu S et al NEJM 2019;但是你還是得考慮不同的患者群體副作用可能很不同),有些實驗步驟可以直接跳過,那有一個步驟是絕對絕對不能跳過的:在大規模給患者使用之前,我們得至少證明它真的有用啊!
到底有沒有用?
聽到這裏你可能有點糊塗了。
剛剛你并不還說美國人已經成功瑞德西韋治愈了一個新冠病毒肺炎的患者麽?這不已經證明有效了麽?
還真不能。
咱們再回顧一下瑞德西韋那條新聞:醫生們給一位症狀嚴重的新冠病毒肺炎患者使用了瑞德西韋,很快觀察到了症狀的緩解。
請注意,這個案例當然是非常激動人心的,但是它可不意味着這種藥它就管用、或者它就适合大規模推廣了。道理很簡單,患者在住院治療期間可不是隻用了瑞德西韋這麽一種藥,你怎麽排除其他治療方法的作用?你怎麽證明患者不是自己慢慢好起來的(特别考慮到新冠病毒肺炎确實存在相當大比例的自愈案例)?你怎麽知道瑞德西韋這次“成功”不是運氣使然,瞎貓碰到死耗子了?
類比一下,在前面的科普裏我也提到北大第一醫院王廣發主任服用了抗艾滋病藥物克立芝之後、自己的新冠病毒肺炎很快好轉的故事。但是這個故事本身也不足以證明克立芝就适合立刻進入臨床指南、大規模推廣應用了。
在這兩個藥物的案例裏,我們仍然需要按捺住沖動,老老實實去完成該做的事情:
在實驗室裏,測試兩種藥物對新冠病毒的抑制作用(吉利德公司宣稱正在做這些實驗;https://www.gilead.com/news-and-press/company-statements/gilead-sciences-statement-on-the-company-ongoing-response-to-the-2019-new-coronavirus);更重要的是,盡快組織設計嚴格和合理的人體臨床試驗,盡可能令人信服地證明兩種藥物真的能夠實實在在的幫助患者。
實際上克立芝已經有相關的臨床試驗啓動了(曹彬等,”一項評價洛匹那韋利托那韋聯合标準治療在2019新型冠狀病毒感染住院患者中的療效和安全性随機、開放、對照的研究“)。
而吉利德公司宣稱已經贈送了一小批瑞德西韋給中國,我相信相關的臨床研究也會很快開展(https://www.gilead.com/news-and-press/company-statements/gilead-sciences-statement-on-the-company-ongoing-response-to-the-2019-new-coronavirus)。
在那之前,我們還是要忍住立刻将“特效藥”大規模推廣的沖動,遵循科學和醫學的自身規律,把該做的事情做好。
應該怎麽用?
當然我估計你可能馬上會有一個新的問題:既然如此,那爲什麽美國醫生可以直接給新冠病毒肺炎的患者用上瑞德西韋?
這是一個特别值得單獨拎出來聊聊的操作,學名叫做“同情用藥”(compassionate use)。
這是美國FDA在2009年特别指定的一項政策,給極其緊急的藥物臨床應用開了一個小小的口子(https://www.fda.gov/news-events/public-health-focus/expanded-access)。按照這項規定,患者如果出現了緊急的而且危及生命的疾病,醫生們可以考慮特别申請使用那些其實還沒有獲得批準上市,仍然在研發過程中的藥物。在這一次,美國醫生面對全美第一例新冠病毒肺炎的患者,就動用了“同情用藥”這個綠色通道,給他争取來了一些還沒上市的試驗性藥物。
但是我想你肯定能夠想到,同情用藥這個後門有一個巨大的風險:它如果開得太大,本質上會讓整個藥物開發和審批流程徹底失效,因爲任何患者和醫生都有可能在焦急的情況下嘗試任何有可能有用的藥物!因此FDA給同情用藥的約束也是非常多的,患者的病情必須極度危急、手頭毫無治療方法、并且人體臨床研究也不可能開展的時候,才會慎重考慮。
美國FDA每年僅僅會批準1000多個患者提出的同情用藥的申請(https://web.archive.org/web/20180517061940/https://www.fda.gov/newsevents/publichealthfocus/expandedaccesscompassionateuse/ucm443572.htm#Expanded_Access_IND1)。考慮到美國人每年加起來求醫問藥的次數超過10億次,同情用藥的适用範圍小到幾乎可以忽略不計。
而針對美國這一例新冠病毒肺炎的患者,實施同情用藥的原因是可以很容易的推測出來的:
患者病情較爲危重,在住院期間仍持續惡化;而且面對一種全新的疾病,病情的後續發展難以預測;
缺乏任何有針對性的有效治療手段;
美國僅有幾例新冠病毒肺炎的患者,無法開展任何有統計意義的人體臨床試驗。
那我們中國的情況呢?很明顯是不一樣的:
在國内,新冠病毒肺炎的患者數量龐大,設計和完成一個人體臨床試驗并不是特别困難的事情;
患者絕大多數是輕症患者,在治療過程中依靠傳統的支持治療和抗病毒治療就足以順利痊愈,也不需要動用未知風險很大的新治療方法。
根據這些讨論,我想瑞德西韋在中國的應用路徑其實就非常清楚了:
吉利德公司贈送的藥物,一部分可以用來搶救病情危重的一部分新冠病毒肺炎患者。中國藥監局也已經在2017年通過了中國版的同情用藥方案,一切都有章可循。
http://www.ccpie.org/cn/yjxx/yphzp/webinfo/2017/12/1515083849140263.htm)
與此同時,這些藥物還應該用來開展正規的人體臨床試驗,盡快确定它對于新冠病毒肺炎患者的安全性和療效。如果還不錯,那麽我們當然就可以大大拓展這種藥物的使用範圍,讓更多患者受益;如果不行,那麽我們也可以在第一時間獲知這些風險,及時叫停“同情用藥”。
而如果确實證明安全好用,我們也可以和吉利德公司一起推動這種藥物的正式上市和進口(同時包括大範圍的降價),保證中國患者能夠使用到。
還是那句話,欲速則不達。
再強調一次,不管疾病有多嚴重,不管我們期待新藥和新疫苗的願望是多麽迫切,新藥和新疫苗開發的規律無法被逾越。随意縮短研究的時間和标準,看起來好像是急人民之所急,但是可能會付出我們誰也無法接受的慘痛代價!
(update一個好消息:瑞德西韋随機、雙盲、對照III期臨床研究光速啓動,總樣本量270例,入組輕、中度新冠肺炎患者,由中日友好醫院曹彬教授牽頭,試驗預期于後天(2月3日)開始,4月27日結束。)
【作者介紹:王立銘,浙江大學教授,科學作家,著有《上帝的手術刀》《生命是什麽》等 ,知名科學科普博主。】
敬請注意: 新聞取自各大媒體,其內容觀點不代表本網立場!
武漢肺炎 相關新聞: