首例臨床患者17小時從重症到恢復 瑞德西韋 真是新冠肺炎神藥?
一起基於“同情用藥”準則下的治愈案例,讓美國製藥公司Gilead幾年前針對埃博拉病毒而研製的藥物瑞德西韋(Remdesivir),成為扼住肆虐的新型冠狀病毒咽喉的新希望。
與此幾乎同時,泰國也宣布發現治療新冠肺炎的藥方,兩種藥物分別是抗艾滋病藥物和抗流感藥物(Oseltamivir),曼谷Rajavithi醫院的醫生團隊表示,經近日的臨床使用發現效果非常好,多名確診病例服用完後,12小時內病情明顯好轉,48小時內痊癒。
多重“好消息”之下,似乎利器已然在手,戰胜新型冠狀病毒迎來曙光。但這些個例背後很難說清,到底是這些“特效藥”起了作用,還是患者自身免疫系統戰勝了病毒。畢竟在國內,沒有這些“特效藥”幫助下,治癒的案例已高達400例。
但不得不承認,這是新型冠狀病毒疫情爆發以來,人們在樸素的戰勝病毒心理下看到的希望所在。
2月3日,瑞德西韋這一“特效藥”隨機、雙盲、對照III期臨床研究正式啟動,總樣本量270例,入組輕、中度新冠肺炎患者,由中日友好醫院曹彬教授牽頭,預期在4月27日結束。
當日晚間,《潛望》從接近該臨床試驗人員處獲悉,瑞德西韋試驗的第一例患者從重症到恢復,用時不到24小時,“效果很好”。不過,與美國宣布用該藥物治癒的患者一樣,目前均為孤例,沒有對照試驗,沒有足夠的臨床樣本,不能證明就是“特效藥”起了作用。
“希望在新藥審批的正規流程下,瑞德西韋能夠開展正規的人體臨床試驗,確定在治療治療新型冠狀病毒感染上的安全性和有效性。”浙江大學教授王立銘在談及瑞德西韋這一“特效藥”時表示,如果證明安全好用,可以和吉利德公司一起推動這種藥物的正式上市和進口,保證中國患者能夠使用到。
但他同時強調,瑞德西韋需要嚴格遵循新藥開發的規律,不能隨意縮短研究的時間和標準。因為“不管疾病有多嚴重,不管我們期待新藥和新疫苗的願望是多麼迫切,新藥和新疫苗開發的規律無法被逾越。”
治愈美國首例新冠病毒患者
據《新英格蘭醫學雜誌》報導,美國首例確診新冠病毒病人於1月15日結束了在武漢的探親返回美國,在返美後的第二天就開始咳嗽,並有些發熱症狀,第三天由於症狀仍未緩解,並在了解到新冠病毒相關消息後,決定去看醫生。
在接受了幾天的治療後,病人的病情並未得到緩解,並有不斷加重趨勢,在住院後第六天,患者出現持續高燒,需要吸氧,肺部X光片顯示出非典型肺炎的特徵。最終患者使用了一種尚未獲批的新藥,由吉利德公司研發的抗病毒藥倫地西韋。
在使用該藥物後的第二天,病人的病情並得到了極大的改善,他不再需要吸氧,除了乾咳和流鼻涕,他已經沒有其他症狀,截至1月30日,這名患者仍在住院觀察,但已經退燒,目前唯一症狀是咳嗽,且嚴重程度在不斷減輕。
值得強調的是,由於倫地西韋是未被美國藥監局(FDA)批准的新藥,因而用在病人身上已經屬於同情用藥(英文名:Compassionate use)的範疇。
所謂同情用藥,是屬於治療過程中的一種極端情況,美國藥監局對其有著非常嚴格的界定,在其官網上,FDA明確列出,必須滿足下列所有條件,才被認為同情用藥是妥當的:
1、病人病情嚴重,或者病情已經能夠立即對生命造成威脅。
2、沒有其他類似或有效的可選診斷、檢測或治療方案
3、病人無法被列入臨床試驗
4、(用藥後)病人潛在能夠收穫的療效,值得付出這樣的風險
5、治療藥物不會對臨床試驗以及治療效果的宣傳產生影響
FDA還專門提醒,對於尚處於試驗階段的新藥或醫療設備的使用,或許將會導致預期之外的嚴重的副作用。
從FDA的上述規定以及再三提醒不難看出,對於未經獲批的新藥的使用,監管當局的態度是極其慎重,只有在極端情況,且滿足各項條件時,才能將未經獲批的新藥用於病患身上。
瑞德西韋與製藥公司Gilead的前世今生
用於美國首例新冠病毒患者的治療的Remdesivir,是由美國生物製藥公司Gilead 幾年前針對非洲流行的埃博拉病毒所研製的抗病毒藥劑,但從臨床試驗效果來看,實際上Remdesivir對埃博拉病毒患者的治療效果並不好,與其他三款針對埃博拉病毒研製的藥劑同時進行臨床試驗時,接受Remdesivir治療的埃博拉病毒感染患者的致死率最高。
在2019年10月由美國國家過敏與傳染病研究機構公佈的一篇論文中稱,總共1400多名接受臨床試驗的患者被隨機分配四種藥的治療,分別是ZMapp、Mab114、REGN-EB3和Remdesivir,最終,接受ZMapp治療的患者死亡率為49%,接受mAb114治療的患者死亡率為34%,接受REGN-EB3治療的患者死亡率為29%,而接受Remdesivir治療的患者死亡率最高,達到53%,埃博拉病毒爆發的總體死亡率為67%。
基於這樣的臨床試驗結果,試驗數據和安全監測委員會決定,繼續進行死亡率最低的兩款藥REGN-EB3和mAB114的試驗,而解除了另兩款藥ZMapp和Remdesivir的繼續試驗。
研製Remdesivir的製藥公司Gilead是一家總部位於美國加州Foster City的生物醫藥公司,從事藥品的研發和商業化,主要研發包括用於治療HIV、甲肝、乙肝和流感等病毒的抗病毒類藥物。
Gilead於1987年創辦,1992年在納斯達克交易所上市交易,目前市值約800億美元,員工數超1萬名。
近年來,Gilead作為一家上市公司的經營業績狀況並不好,近三年銷售收入連年下滑,2018年銷售收入同比下滑16%至217億美元,其中HIV相關藥物銷售下滑12%至146億美元, HCV相關藥物銷售大幅下滑60%至37億美元。
去年全年,Gilead股價下跌7%,而標普醫藥板塊去年整體則上漲17%。在治愈美國首例新冠病毒患者之前,Gilead的股價一度已經下滑到7年新低。由於美國首例新冠病毒患者接受Remdesivir的消息,使得Gilead股價在消息當天一度上漲超過7%。
將用於大規模臨床試驗
2月2日,中國國家藥監局藥品審評中心(CDE)正式受理瑞德西韋的臨床試驗申請。2月3日,瑞德西韋這一“特效藥”隨機、雙盲、對照III期臨床研究正式啟動,總樣本量270例,入組輕、中度新冠肺炎患者,由中日友好醫院曹彬教授牽頭,在武漢疫區展開,預期在4月27日結束。
中日友好醫院在官網表態,在武漢疫區牽頭開展瑞德西韋(Remdesivir)治療2019-nCoV新型冠狀病毒臨床研究,將“為抗擊疫情帶來曙光。”
但結合目前所掌握的現有信息來看,至少有幾方面的問題值得提出:
首先,Remdesivir在治愈美國患者這件事中所起到的作用還未能得到充分的論證。
根據《新英格蘭醫學日誌》1月31日所刊登的文章敘述,在首例新冠病毒患者入院第7天晚對其使用Remdesivir,第8天,病人的病情得到顯著改善,血氧水平從94%上升至96%,但文章僅僅是客觀敘述事實,並沒有做出任何“是因為使用Remdesivir而使病人病情好轉”的結論。
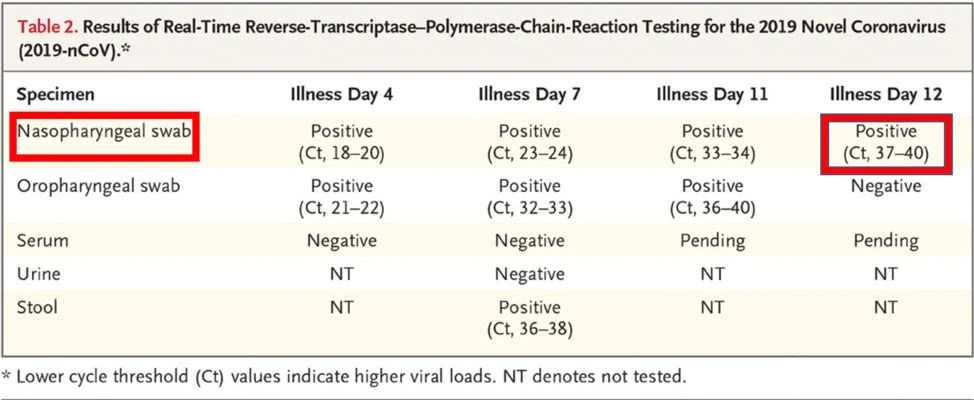
此外,一位熟悉該流程的美國醫學教授對《潛望》指出,在介紹其診療過程的文章中,患者第12天鼻腔試紙病毒檢測結果並未轉陰,依然呈陽性,並不符合國家頒布的治愈標準。
在Gilead公司隨後發表的聲明中,該公司除了強調本藥並沒有獲批,還處於臨床試驗階段外,也表示,Remdesivir對於與新型冠狀病毒結構相似的SARS和MERS病毒有一定效果外,並沒有直接的對新型冠狀病毒有效的數據,該公司也沒有在聲明中明確表示,美國首例新型冠狀病毒患者狀況改善是因為該藥所起的效果。
其次,即便是有充分證據說明美國首例治愈病例確實是因為Remdesivir起作用,但別忘了該藥最初是針對埃博拉病毒進行研發,現在卻對新冠病毒起作用,這裡面的運作機理,目前還沒有任何公開信息說明,該公司也未對其做任何說明。從醫學角度來說,容不得半點的“歪打正著”或“東方不亮西方亮”,對於為何原先用於埃博拉病毒的藥物,現在對新冠病毒起作用,還需要有更有說服裡的專業佐證才行。
前述醫學教授表示,這一藥物在美國進行了I期和II期實驗,但II期實驗失敗,如今面對對抗病毒主體的更換,在中國緊急啟動III期臨床試驗,可能是“特事特辦”,在疫情緊急的情況下一路綠燈。
不過針對埃博拉和新型冠狀病毒,吉利德此前曾表示,在體外和動物模型中,瑞德西韋證實了對非典型性肺炎(SARS)和中東呼吸綜合徵(MERS)的病毒病原體均有活性。後兩者也屬于冠狀病毒,與新型冠狀病毒在結構上非常相似。
《潛望》 作者紀振宇劉鵬
敬請注意: 新聞取自各大媒體,其內容觀點不代表本網立場!
武漢肺炎 相關新聞: